КОРРЕКЦИЯ КАРДИОТОКСИЧНОСТИ У ОНКОЛОГИЧЕСКИХ ПАЦИЕНТОВ
Полтавская Мария Георгиевна, профессор кафедры кардиологии, функциональной и ультразвуковой диагностики Первого МГМУ им. И.М. Сеченова, руководитель научно‑практического центра кардиоонкологии Первого МГМУ им. И.М. Сеченова, д.м.н.
Современные методы лечения рака, улучшая прогноз онкологических заболеваний, одновременно могут приводить к развитию серьезных сердечно‑сосудистых осложнений, негативно влиять на качество жизни и прогноз выживаемости пациентов. Решение проблемы видится в создании единого представления о профилактических и терапевтических мерах в отношении индуцированных сосудистых патологий и неукоснительном следовании этим подходам.
Опубликованные рекомендации

В настоящее время врачам доступны различные рекомендации и руководства по кардиоонкологии. К сожалению, рандомизированных исследований в этой области крайне мало, поэтому рекомендации базируются в основном на наблюдательных исследо-ваниях, часто ретроспективных, опыте ведения ма-лых серий и отдельных пациентов. Хорошо известен опубликованный в 2016 г. Меморандум Европейского общества кардиологов ESC по лечению онкологиче-ских заболеваний и сердечно-сосудистой токсич-ности (ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice), доступный в переводе на сайте РКО. В 2020 г. вышел Консенсус Европейско-го общества клинической онкологии по коррекции сердечно-сосудистых поражений у пациентов со зло-качественными новообразованиями на фоне онколо-гического лечения (Management of cardiac disease in cancer patients throughout oncological treatment: ESMO consensus recommendations). Кроме того, врачи должны учитывать такой документ, как «Позиция экспертов по оценке сердечно-сосудистого риска до назначения кардиотоксичной терапии» (Baseline cardiovascular risk assessment in cancer patients scheduled to receive cardiotoxic cancer therapies). Российское общество клинической онкологии (RUSSCO) ежегодно обновляет рекомендации по поддерживающей и сопроводи-тельной терапии в онкологии, включающие крат-кое руководство по коррекции кардиоваскулярной токсичности (информация размещается на сайте rosoncoweb.ru).
Кардиотоксичность: причины и степень тяжести
Современная противораковая терапия, воздействуя на молекулярные и клеточные мишени опухоли, может негативно влиять на здоровые клетки организма, в том числе на кардиомиоциты и эндотелий сосудов. Мультикиназные ингибиторы (сорафениб), например, могут удлинять интервал QT, антрациклины и трастузумаб – вызвать дисфункцию миокарда и сердечную недостаточность, а ингибиторы фактора роста эндотелия сосудов, предотвращая рост опухоли, одновременно обуславливать развитие артериальной гипертензии и тромбозов. Все нежелательные сердечно‑сосудистые явления, связанные с противоопухолевой терапией, относят к кардиотоксичности, которую классифицируют по 4‑балльной шкале, где 4 балла – это опасное для жизни состояние, которое делает невозможным продолжение химиотерапии. Если кардиотоксичность оценивается в 3 балла, требуется взвешенное решение – продолжать терапию или отменять.
В 2020 г. опубликовано наблюдательное исследование – Classification, prevalence, and outcomes of anticancer therapy‑induced cardiotoxicity: the CARDIOTOX registry, которое показывает, что у пациентов, получающих лечение, сопряженное с высоким риском кардиотоксичности (у большинства пациентов – антрациклины), тяжелая кардиотоксичность развивается примерно в 3% случаев.
Проявления кардиотоксичности
Хорошо известно о формировании дисфункции левого желудочка и сердечной недостаточности, но значительно чаще под влиянием химиотерапии могут развиться или ухудшиться ИБС, аритмии, удлинение интервала QT, нарушения проводимости, артериальная гипертензия. Значимо возрастает частота не только венозных, но и артериальных тромбозов, особенно в первые 3 месяца химиотерапии. В 2,8 раза увеличивается риск инфаркта и в 1,9 раза – риск инсульта. Причем частота инфаркта и инсульта коррелирует со стадией онкологического процесса.
ИБС, которая развивается на фоне противораковой терапии, может иметь самые различные проявления. Помимо развития ОКС с подъемом или без подъема сегмента ST, у больного может наблюдаться стабильная стенокардия, бессимптомное поражение коронарных артерий, вазоспастическая или микроваскулярная ишемия. ОКС может не сопровождаться подъемом сегмента ST и часто проявляется не болью, а затруднением дыхания и одышкой, что осложняет диагностику.
Дополнительным фактором риска сосудистых событий служит прекращение кардиальной терапии (статины, иАПФ, бета‑адреноблокаторы) у пациентов с коронарной болезнью. В первые 4 месяца противоракового лечения у четверти пациентов регистрируется госпитализация по поводу ИБС, а не по поводу рака. В 2 раза увеличивается риск ишемии миокарда и инсульта.
Очень частое осложнение у пациентов, получающих химиотерапию, – артериальная гипертензия. Ее развитие на фоне ингибиторов фактора роста эндотелия сосудов (бевацизумаб, сорафениб, сунитиниб, пазопаниб и др.) коррелирует с противоопухолевой эффективностью и дозами препаратов. Риск артериальной гипертензии увеличивается при наличии артериальной гипертонии в анамнезе.
Мониторинг показателей кардиотоксичности
На фоне терапии препаратами, способствующими формированию дисфункции левого желудочка и сердечной недостаточности, прежде всего антрациклинами, оценивают величину фракции выброса левого желудочка. Если во время лечения она снижается на 10% и становится ниже 50%, химиотерапию следует приостановить и направить пациента к кардиологу. Однако при этом нужно учитывать одну очень важную деталь. УЗ‑исследование должен делать один оператор, потому что в противном случае слишком велик риск большой погрешности.
Референсными методами могут быть магнитно‑резонансная томография и радионуклидная ангиография, однако эти исследования слишком дороги и не могут использоваться в массовой практике, тем более для серийного применения в динамике. Кроме того, фракция выброса снижается достаточно поздно – уже после окончания химиотерапии. Более ранним и чувствительным эхокардиографическим показателем является нарушение продольной деформации левого желудочка, определяемое с помощью спекл‑трекинг эхокардиографии, однако в широкой практике этот метод пока недоступен.
Острый коронарный синдром без подъема ST требует оценки риска по шкале TIMI, при этом к сумме баллов прибавляют 1 балл за счет фактора риска онкологического заболевания. При риске ≥3 баллов необходима ранняя инвазивная тактика
Значительно более простым способом выявить проявления кардиотоксичности на раннем этапе является определение тропонина. Прогностическое значение имеет персистирующее повышение тропонина, и его оценивают, как правило, перед началом следующего курса химиотерапии. Чаще изменения начинают регистрироваться на 3–4‑м курсе лечения. У большинства пациентов повышения уровня тропонина может и не наблюдаться (тропонин‑негативные пациенты).
Пациенты, у которых хотя бы однажды повышался тропонин на фоне химиотерапии, имеют несколько худший прогноз в плане различных сердечно‑сосудистых событий. Особенно те, у кого повышенный уровень сохранялся и через месяц после окончания химиотерапии. Именно эти больные в первую очередь требуют особого наблюдения для предупреждения различных неблагоприятных событий и нуждаются в назначении кардиопротективной терапии.
Предлагается также мониторировать и еще один показатель – уровень натрийуретического пептида (BNP), однако его повышение «отстает» от тропонина и свидетельствует об уже наступившей дисфункции левого желудочка. Его прогностическое значение не установлено, однако повышение требует назначения кардиопротективной терапии.
Препараты, обладающие кардиотоксичностью
Наиболее широко известно о кардиотоксичности антрациклинов, которые вызывают необратимое повреждение кардиомиоцитов, дисфункцию миокарда и сердечную недостаточность. Как правило, фракция выброса на этой терапии снижается в первые 12 месяцев, в среднем – через 3,5 месяца после окончания химиотерапии.
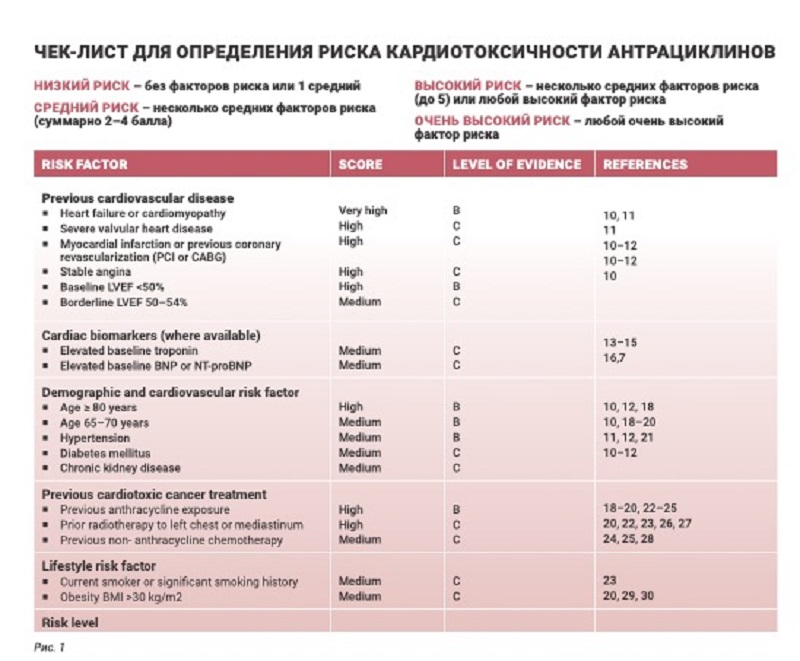
Для оценки риска кардиотоксичности до назначения этих противоопухолевых препаратов, как и еще 6 групп, можно воспользоваться опубликованным в 2020 г. документом Baseline cardiovascular risk assessment in cancer patients scheduled to receive cardiotoxic cancer therapies. Должны учитываться данные анамнеза, показатели АД, HbA1c, липидного профиля, биомаркеров (тропонин, мозговой натрийуретический пептид) и данные электрокардио- и эхокардиографии. Самым значимым фактором риска является уже имевшее место сердечно‑сосудистое заболевание в анамнезе (рис. 1).
Все эти данные отмечаются в специальном чек‑листе. И если суммарный риск оказывается высоким, онколог должен направить пациента к кардиологу для решения вопросов о возможности назначения данной противоопухолевой терапии, необходимости кардиопротекции и коррекции кардиальной терапии. При этом крайне важно (обязательно!) максимально скорректировать модифицируемые факторы риска – ИБС, курение, артериальное давление, ожирение, уровень гликемии.
Трастузумаб, который используется при лечении пациентов с РМЖ, представляет собой моноклональные антитела, которые связываются белком‑рецептором на поверхности злокачественных клеток, задерживая их пролиферацию. Однако одновременно они связываются с этими рецепторами и на поверхности клеток миокарда, препятствуя восстановительным процессам. На фоне трастузумаба фракция выброса левого желудочка (ФВ ЛЖ) может падать, но после отмены препарата восстанавливаться. Однако в случае комбинированной терапии с антрациклинами (доксорубицин) или назначения трастузумаба после доксорубицина частота развития кардиомиопатии резко возрастает.
Терапия производными платины, ингибиторами VEGF (бевацизумаб, сунитиниб) и другими препаратами может сопровождаться тромбозами, в том числе артериальными, и дестабилизацией атеросклеротического поражения сосудов. Следует отметить, что «сосудистая токсичность» – артериальная гипертензия, ишемия миокарда наблюдается чаще, чем развитие кардиомиопатии. Так, например, классическим проявлением кардиотоксичности флюоропиримидинов (5‑фторурацил, капецитабин) является коронарный спазм. Сроки развития ишемических осложнений варьируются в очень широких пределах – они могут наблюдаться с первых минут инфузии химиопрепаратов (5‑фторурацил, ритуксимаб, винкристин), а могут возникать спустя недели (цисплатин) и месяцы (ингибиторы тирозинкиназы BCR ABL) после лечения.
Андрогенная депривация, в частности агонисты гонадотропин‑рилизинг‑гормона, при раке предстательной железы повышает риск инфаркта миокарда. В первую очередь это происходит потому, что данные гормональные препараты способствуют развитию метаболического синдрома, повышают свертываемость крови и агрегацию тромбоцитов, ускоряют развитие атеросклероза. Такие пациенты нуждаются в стратификации риска сосудистых событий с применением шкалы SCORE.
Осложнения лучевой терапии
У пациентов, получивших лучевую терапию, клинически значимые осложнения со стороны сердца могут возникать в очень отдаленном периоде, обычно спустя 10 и более лет. Они возникают, когда в проекции облучения оказывается сердце, как, например, при лимфоме Ходжкина или раке молочной железы. Постлучевые осложнения могут длительно прогрессировать бессимптомно, однако становятся наиболее частой причиной неонкологической смертности у таких пациентов (1/4–1/3 общей смертности).
К кардиологу пациенты попадают уже в стадии хронического фиброза структур сердца. Из ранних проявлений можно отметить острый перикардит, который развивается как реакция на высокую дозу облучения либо на деструкцию опухоли и может проходить самостоятельно, а может потребовать НПВС и колхицина. Хроническое поражение перикарда проявляется спустя годы персистирующим выпотом и/или констрикцией перикарда и может потребовать хирургического вмешательства. Подход к перикардэктомии при постлучевой констрикции должен быть особенно взвешенным, поскольку периоперационная смертность в этих случаях достигает 20%.
Нередкое осложнение лучевой терапии – поражение клапанов (фиброз и кальцификация кольца митрального клапана, аортомитральной занавески, створок клапанов). Клинически значимые поражения, требующие хирургической коррекции, в основном характерны для аортального клапана. Эти изменения также длительно не дают клинической симптоматики и проявляются спустя годы после лучевой терапии. Среднее время до постановки диагноза составляет 22 года. Лечение предусматривает хирургическое вмешательство – протезирование клапана.
Следует помнить о вероятности стресс‑индуцированной кардиомиопатии (такоцубо) – описаний таких случаев у онкологических пациентов достаточно много. В этом случае отменяют антикоагулянты и ингибиторы P2Y12‑рецепторов и проводят терапию сердечной недостаточности
Признаки микроваскулярного поражения миокарда можно отметить в ранние сроки после лучевой терапии – это дефекты перфузии, в покое или стресс‑индуцированные, кардиалгии и нестойкие локальные гипокинезы на ЭхоКГ. Их прогностическое значение не установлено. В отдаленные сроки (как правило, через 10 и более лет) развивается фиброз миокарда с формированием рестриктивной кардиомиопатии. Она характеризуется диастолической и (значительно позже) умеренной систолической дисфункцией, нарушением проводимости и автоматизма. И следует отметить, что диагностика этого заболевания затруднена в связи с рядом отличий от «обычной» сердечной недостаточности. Стоит обратить внимание на отсутствие компенсаторного ремоделирования левого желудочка, в частности увеличения его объема (возможно даже его уменьшения). Зачастую отсутствует и расширение предсердий, а фракция выброса нормальная или снижена незначительно. Все это сочетается с застойной сердечной недостаточностью. Облегчить диагностику помогает использование тканевой допплерографии.
ИБС, возникающая после облучения, также имеет свои особенности. В первую очередь врача должен настораживать молодой возраст, а длительная бессимптомность заболевания определяет необходимость регулярного скрининга с помощью нагрузочных тестов. Морфологически выявляется атеросклероз (хотя и несколько больше фиброза, меньше липидов, чем при обычном атеросклерозе), иногда тенденция к более протяженным стенозам и хрупкость артерий.
Профилактика
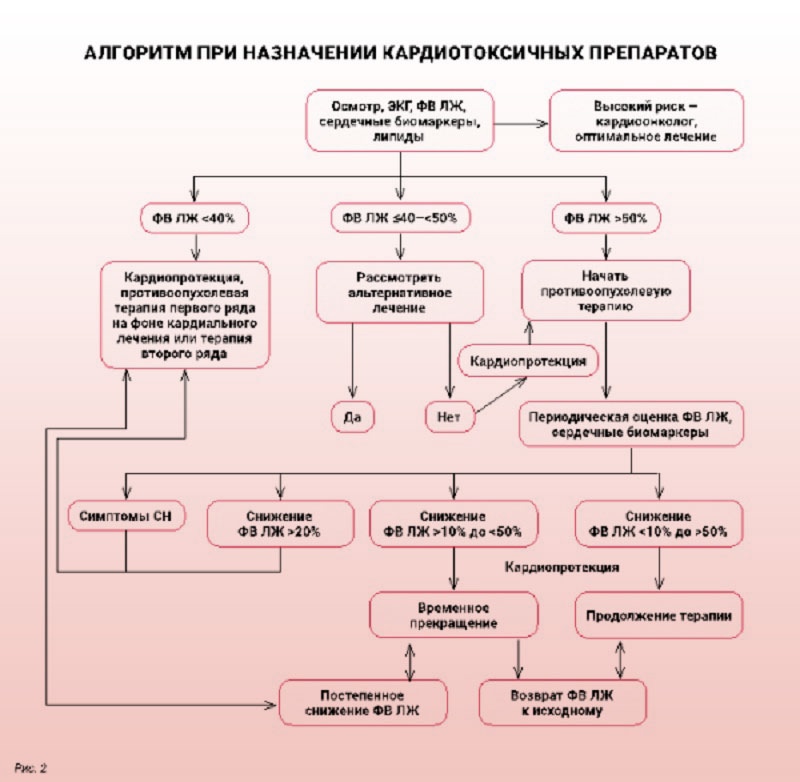
В настоящее время для пациентов, получающих антрациклины и другие препараты, способные вызывать дисфункцию левого желудочка, разработаны определенные подходы к профилактике осложнений. При ведении онкологического пациента следует использовать четкий алгоритм, который регламентирует необходимость начала кардиопротективного лечения (рис. 2). Эффективность предупреждения сердечно‑сосудистых событий находится в прямой зависимости от сроков начала лечения и в обратной – от степени повреждения кардиомиоцитов. У пациентов с высоким риском кардиотоксичности следует назначать кардиопротективную терапию до начала химиотерапии. У пациентов с более низким риском целесообразно назначение кардиопротективной терапии при первых признаках поражения миокарда, основываясь на уровне тропонина.
Для профилактики кардиотоксичности при ее заведомо высоком риске, в частности, при необходимости применения высоких доз доксорубицина, особенно у пациентов с уже имеющимися признаками поражения сердца, рекомендуется дексразоксан.
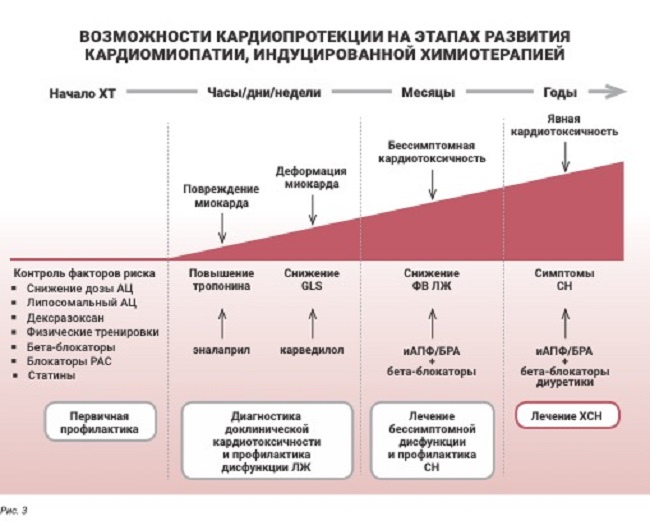
Наиболее убедительная доказательная база в плане предотвращения снижения фракции выброса и даже ее восстановления в случае снижения (при условии быстрого вмешательства) – у ингибиторов АПФ/БРА, сартанов, несколько меньше – у бета‑адреноблокаторов (причем не у всех). Превентивным действием обладают также статины, которые к тому же в наблюдательных исследованиях продемонстрировали противоопухолевую эффективность. Последовательность введения кардиопротективной терапии на различных этапах кардиотоксичности может проиллюстрировать простая схема (рис. 3).
Основные подходы к терапии
Основные принципы лечения сердечно‑сосудистых патологий у онкологических пациентов должны быть такими же, как и у пациентов без рака. В частности, при определении показаний к реваскуляризации (и соответственно, к коронароангиографии) у пациентов со стабильной ИБС следует исходить в первую очередь из тяжести документированной ишемии миокарда и учитывать повышенную склонность этих пациентов как к кровотечениям, так и к тромбозам (в т. ч. к тромбозу стента), а также необходимость хирургического лечения опухоли, тромбоцитопению и другие особенности. При остром коронарном синдроме с подъемом сегмента ST тактика лечения должна включать все мероприятия, предусмотренные алгоритмом, независимо от онкологического диагноза. Острый коронарный синдром без подъема ST требует оценки риска по шкале TIMI, при этом к сумме баллов прибавляют 1 балл за счет фактора риска онкологического заболевания. При риске ≥3 баллов необходима ранняя инвазивная тактика.
Следует помнить о вероятности стресс‑индуцированной кардиомиопатии (такоцубо) – описаний таких случаев у онкологических пациентов достаточно много. В этом случае отменяют антикоагулянты и ингибиторы P2Y12‑рецепторов и проводят терапию сердечной недостаточности. После восстановления фракции выброса левого желудочка можно рассматривать возобновление противораковой терапии.
Антитромботическую терапию после острого коронарного синдрома ведут по общим правилам. Однако если пациент перенес ЧКВ на фоне «активного» рака, следует стремиться к наименьшей по срокам двойной антиагрегантной терапии.
Артериальная гипертензия, которая сопровождает химиотерапию, требует превентивной оптимизации антигипертензивной терапии у пациентов с АГ в анамнезе и регулярного контроля АД после начала терапии. Лечение АГ ведут по общим правилам, оно может включать ингибиторы АПФ, блокаторы рецепторов ангиотензина или дигидропиридиновые антагонисты кальция. При протеинурии и сердечной недостаточности предпочтительны АПФ и БРА. Диуретики следует применять с большой осторожностью с учетом возможных электролитных нарушений и возможности удлинения QT. Нежелательно назначение верапамила и дилтиазема, которые часто вступают в лекарственные взаимодействия.
Требуется пожизненное наблюдение
Если пациент получал потенциально кардиотоксичную химиотерапию, ему рекомендуется пожизненное наблюдение. Он должен в обязательном порядке проходить ежегодную диспансеризацию, предусматривающую как минимум опрос и осмотр. В случае применения препаратов с длительной сосудистой токсичностью или лучевой терапии, направленной на грудную клетку, голову и шею, необходимы и дополнительные инструментальные методы обследования. При отсутствии симптомов раз в 5 лет следует проводить УЗДГ брахиоцефальных артерий, ЭхоКГ, оценку лодыжечно‑плечевого индекса, по показаниям – КТ коронарных артерий, а у пациентов с высоким сердечно‑сосудистым риском – нагрузочные тесты для выявления безболевой ишемии миокарда. При наличии симптомов пациенты проходят соответствующее стандартное обследование.