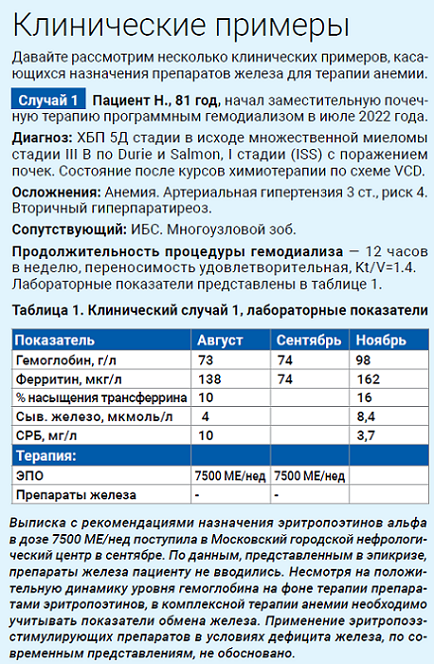
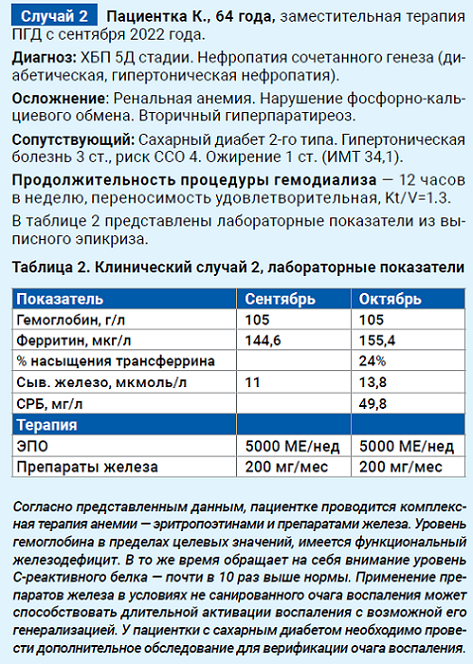
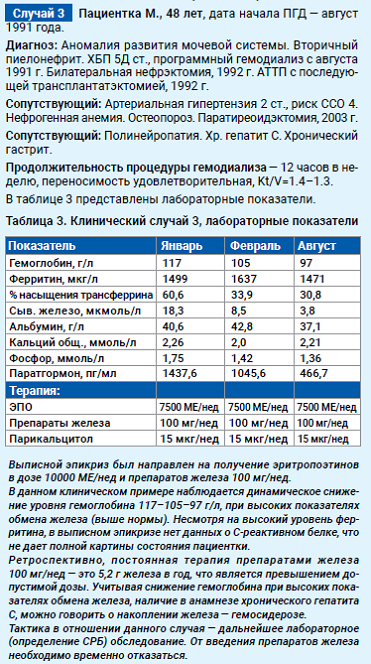
Коррекция железодефицитных состояний у пациентов на программном гемодиализе
Анемия — одно из частых и наиболее серьезных осложнений хронической болезни почек (ХБП), сильно влияющее на качество и продолжительность жизни пациентов. Это синдром, при котором отмечается снижение концентрации гемоглобина в крови, чаще при одновременном уменьшении числа эритроцитов (или общего объема эритроцитов). Анемия появляется у пациентов с заболеванием почек при уменьшении скорости клубочковой фильтрации (СКФ) ниже 50 мл/мин/1,73 м2. Чем выше стадия ХБП, тем больше вероятность развития анемии. Так, например, у пациентов с ХБП 3 ст. анемия встречается в 43% случаев, ХБП 4 ст. — в 62%, у пациентов на 5 ст. до начала диализной терапии — в 84%, а у пациентов на программном гемодиализе — в 95%.
Распространенность и причины анемии

Екатерина Дорофеева,
врач-нефролог консультативно-диагностического нефрологического отделения ГКБ № 52 ДЗМ
Известно, что анемия диагностируется у подавляющего большинства пациентов с терминальной стадией почечной недостаточности, но в отдельных случаях снижение гемоглобина может наблюдаться и на более ранних стадиях ХБП, при этом на ее выраженность самым непосредственным образом может влиять первичная нефропатия, приведшая к хронической почечной недостаточности. Например, при диабетической нефропатии анемия уже может наблюдаться при скорости клубочковой фильтрации (СКФ) <90 мл/мин/1,73м2 у мужчин и <70 мл/мин/1,73м2 у женщин. У пациентов с микроальбуминурией анемия может наблюдаться еще раньше. К 3 ст. ХБП более 20% больных диабетической нефропатией имеют анемию.
В последние годы все большее внимание уделяется предупреждению и замедлению прогрессирования анемии на ранних стадиях в структуре рено- и кардиопротекции у больных с ХБП. У значительного числа пациентов к началу заместительной почечной терапии анемия весьма выражена. Доказано, что своевременная коррекция анемии может способствовать и уменьшению темпов прогрессирования ХБП.
Поэтому коррекцию анемии можно рассматривать как важную часть ренопротективной стратегии для снижения риска заболеваемости и смертности этой категории пациентов как до, так и после начала заместительной почечной терапии.
Выраженность и длительность анемии при ХБП во многом определяет тяжесть астенического синдрома у больных, степень переносимости ими физической нагрузки, снижение эффективности умственной деятельности, восприимчивость к инфекционным заболеваниям.
Особенно велика роль анемии в прогрессировании гипертрофии миокарда левого желудочка (ГМЛЖ), обнаруживаемой у 45–55% больных, поступающих на лечение программным гемодиализом (ПГД) и ПАПД. ГМЛЖ у пациентов с анемией и ХБП — это компенсаторный механизм из-за низкого поступления кислорода к жизненно важным органам. При дальнейшем, длительном развитии ГМЛЖ риск смерти пациента увеличивается в 4 раза, риск острого инфаркта миокарда — в 3–6 раз, риск развития острой левожелудочковой недостаточности и тяжелых нарушений ритма — в 4 раза.
Анемия при ХБП имеет многофакторный генез. Основные причины заболевания:
— снижение синтеза гормона роста эритроцитов — эритропоэтина в перитубулярных клетках проксимальной части нефрона;
— дефицит железа из-за неадекватного всасывания в кишечнике. Именно поэтому на поздних стадиях ХБП терапия пероральными препаратами железа малоэффективна;
— острые и хронические инфекции, сопутствующее воспаление и другие состояния, сопровождающиеся избыточной продукцией провоспалительных цитокинов, также способны не только вызвать, но и усугубить течение анемии. Установлено, что цитокин-индуцированное воспаление непосредственно ингибирует действие эндогенного и экзогенного ЭПО на эритроидные предшественники и частично блокирует мобилизацию и транспорт железа;
— тяжелый вторичный гиперпаратиреоз. Паратгормон потенциально влияет на секрецию эритропоэтина почечными перитубулярными фибробластами посредством косвенных механизмов, воздействующих на чувствительность эритроидных предшественников к эритропоэтину.
Причинами анемии в популяции диализных пациентов с терминальной почечной недостаточностью, принимающих заместительную почечную терапию, прежде всего являются снижение продукции эритропоэтина, дефицит железа, повышенное разрушение и гибель эритроцитов вследствие внутри/внесосудистого гемолиза, кровопотери из-за повторных венепункций.
Диагностика анемии при ХБП
Анемия при ХБП может развиваться не только из-за дефицита эритропоэтина. Причины могут быть различными. Базовое клинико-лабораторное обследование призвано дать информацию о степени и типе анемии, активности эритропоэза, о наличии функционально активного железа, доступного для эритропоэза, и его запасах. Исследование концентрации эритропоэтина в плазме крови не имеет диагностической ценности и, как правило, не требуется. Простое сочетание «наличия ХБП и снижения гемоглобина» не является основанием для диагноза «ренальной» анемии, диагноз устанавливается после исключения анемии другого происхождения. При несоответствии между выраженностью анемии и тяжестью течения ХБП необходимо тщательно исследовать все возможные причины формирования анемии у пациента. А при отрицательных тестах, в отсутствие данных в пользу любой иной этиологии анемии (железодефицит/кровопотери, опухоли, цитостатики, гемолиз и пр.) c высокой долей вероятности можно говорить о дефиците продукции ЭПО как причине снижения гемоглобина.
Концентрацию гемоглобина (Hb) правильнее определять в периферической венозной крови. Для пациентов до начала заместительной почечной терапии и пациентов, получающих перитонеальный диализ (ПД), время взятия пробы несущественно, так как объем плазмы у них является относительно постоянной величиной. Однако для пациентов на гемодиализе время взятия пробы для лабораторного анализа — важный фактор, и определять уровень гемоглобина следует только в пробах, полученных до начала процедуры ГД. Пробы крови у больных на ГД нежелательно брать после 2‑дневного интервала (как правило, после выходных), так как возрастает вероятность недооценки концентрации Hb в постдиализном периоде. Рекомендуется до назначения средств, стимулирующих эритропоэз (ССЭ), провести первичное клинико-лабораторное обследование для выявления иных возможных причин анемии, усугубляющих относительный дефицит эритропоэтина. Диагноз анемии как осложнения ХБП должен рассматриваться, если имеется значительное нарушение функции почек, а по результатам проведения диагностических исследований не было установлено иных причин возникновения анемии, кроме ХБП.
Базовое первичное клинико-лабораторное обследование должно включать определение следующих показателей:
— концентрация Hb — для определения степени анемии;
— эритроцитарные индексы (средний корпускулярный объем [MCV] и среднее содержание Hb [MCH]) — для выявления типа анемии;
— количество ретикулоцитов (абсолютное) — для оценки активности эритропоэза;
— концентрация ферритина в плазме (сыворотке) — для определения запасов железа (NB: при интерпретации уровня ферритина следует помнить, что данный показатель повышается при воспалительном процессе, поскольку ферритин является острофазным белком. В таком случае при назначении терапии препаратами железа необходимо опираться на процент насыщения трансферрина. При наличии активного воспалительного процесса нельзя вводить препараты железа);
— количество железа, доступного для эритропоэза, оценивают путем измерения одного из следующих параметров:
а) коэффициент насыщения трансферрина (% TSAT) в плазме или сыворотке;
в) процентное соотношение гипохромных эритроцитов (HRC);
с) концентрация С-реактивного белка в плазме или сыворотке — для выявления воспалительной реакции.
В случае недостаточной информативности данных, полученных на начальном этапе, следует провести развернутое клиническое обследование, которое может включать:
— выявление кровопотери через ЖКТ (тест на скрытую кровь);
— исследование концентрации в плазме витамина В12 и содержания фолиевой кислоты;
— концентрацию в плазме или сыворотке интактного паратиреоидного гормона (iPTH);
— расчет лейкоцитарной формулы крови и определение количества тромбоцитов;
— гемолитические тесты;
— электрофорез или иммуноблоттинг белков крови (мочи);
— в отдельных случаях — электрофорез Hb и исследование костного мозга.
Дефицит железа – фактор развития ренальной анемии
Дефицит железа — важный фактор развития почечной анемии. При этом следует различать относительный и абсолютный (функциональный) дефицит железа. Абсолютный — это общее снижение запасов железа в организме, определяемое при падении ферритина сыворотки ниже 100 мкг/л. Функциональный дефицит железа (ферритин > 100 мкг/л, при этом коэффициент насыщения трансферрина < 20%) проявляется неспособностью обеспечить пролиферирующие эритробласты необходимым количеством железа, несмотря на достаточные запасы железа в организме. Функциональный дефицит железа нередко развивается во время коррекции анемии препаратами рчЭПО, при воспалительных заболеваниях или при недооценке степени хронической кровопотери.
Показатели обмена железа (ферритин сыворотки, Hb и коэффициент насыщения трансферрина и/или процент гипохромных эритроцитов) необходимо определять не реже 1 раза в 3 месяца.
Целевые лабораторные показатели для пациентов на программном гемодиализе: Hb= 100–120 г/л; ферритин > 200–500 мкг/л; насыщение трансферрина > 30%.
В терапии анемии необходим персонифицированный подход, учитывающий возраст, пол, степень физической активности пациента.
Таким образом, в реальной клинической практике до настоящего времени существует несколько стратегий терапии ренальной анемии, которые подбираются исходя из целей терапии с учетом персонифицированного подхода: это восполнение дефицита железа и поддерживающая терапия парентеральными препаратами железа; терапия эритропоэзстимулирующими (ЭСП) препаратами; контроль и терапия ВГПТ; контроль за воспалением (острым и хроническим); терапия сопутствующих заболеваний.
СТРАТЕГИИ ТЕРАПИИ РЕНАЛЬНОЙ АНЕМИИ
- восполнение дефицита железа и поддерживающая терапия парентеральными препаратами железа;
- терапия эритропоэзстимулирующими (ЭСП) препаратами;
- контроль и терапия ВГПТ;
- контроль за воспалением
(острым и хроническим); - терапия сопутствующих заболеваний;
- использование новых препаратов ингибиторов HIF-PH.
Если мы проводим терапию анемии препаратами железа, то должны четко следовать установленным правилам:
– Состояние обмена железа нужно исследовать до начала терапии эритропоэзстимулирующими препаратами. При наличии железодефицита надо сначала восполнить недостаток железа, затем начинать ЭПО-терапию.
– Внутривенный — оптимальный способ введения препаратов железа для пациентов с ХБП, так как у больных с уремией значительно снижена степень абсорбции железа в ЖКТ. Данный способ обязателен для восполнения неизбежных потерь крови у пациентов на гемодиализе (1–4 л крови/год).
– Применение препаратов железа внутрь допустимо у больных на ранних стадиях ХБП. При низкой эффективности следует вводить железо внутривенно.
– Нет однозначных рекомендаций относительно частоты назначения препаратов железа, необходим регулярный лабораторный контроль показателей.
– При выборе препарата железа необходимо учитывать профиль его безопасности и переносимости.